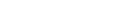稀硫酸与铁的反应方程式
稀硫酸和铁反应方程式是:2Fe+6H2SO4=Fez(SO4)3+3SO2↑+6H2OFe+H2SO4=FeSO4+H2↑。
稀硫酸和铁反应的反应条件是稀硫酸,反应现象是反应缓慢,其中有气泡产生,溶液由无色渐变为浅绿色,生成气体且能够燃烧,产生淡蓝色火焰。稀硫酸指的是溶质的质量分数小于或等于70%的硫酸的水溶液,因为稀硫酸中的硫酸分子被完全电离,所以稀硫酸不具备浓硫酸的强氧化性,脱水性等特殊化学性质。
稀硫酸与铁反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑
反应现象:固体逐渐溶解,固体表面产生大量气泡。
反应类型:①置换反应②氧化还原反应
反应原理:铁的金属活动性比氢强,铁能将氢从硫酸中置换出来生成氢气。
金属活动性顺序表(由强到弱):
K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au
1、铁和稀硫酸反应的化学方程式为:Fe+H2SO4=H2↑+FeSO4。铁和稀盐酸反应生成氯化亚铁和氢气,属于置换反应。
2、铁是一种金属元素,原子序数26,铁单质化学式:Fe。纯铁是白色或者银白色的,有金属光泽。熔点1538℃、沸点2750℃,能溶于强酸和中强酸,不溶于水。铁有0价、+2价、+3价和+6价,其中+2价和+3价较常见,+6价少见。
3、铁易溶于稀的无机酸中,生成二价铁盐,并放出氢气。在常温下遇浓硫酸或浓硝酸时,表面生成一层氧化物保护膜,使铁“钝化”,故可用铁制品盛装冷的浓硫酸或冷的浓硝酸。在加热时,铁可以与浓硫酸或浓硝酸反应,生成+3价的铁盐,同时生成SO2或NO2。
稀硫酸是硫酸(H2SO4)的水溶液,是化合物。铁(Fe)为活泼的金属单质。在化合物与单质之间发生的是置换反应。这类反应要求参加反应的单质活动性比化合物中所置换的元素强。而在金属活动性顺序表中,铁元素位于氢之前,活动性比氢强,方程式Fe十H2SO4=FeSO4十H2↑。